Atomfizika
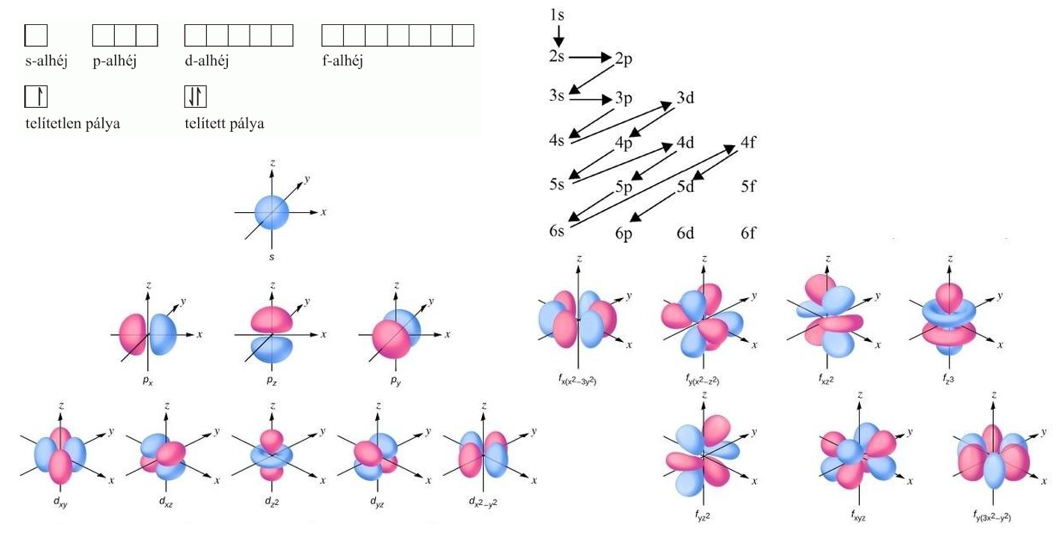
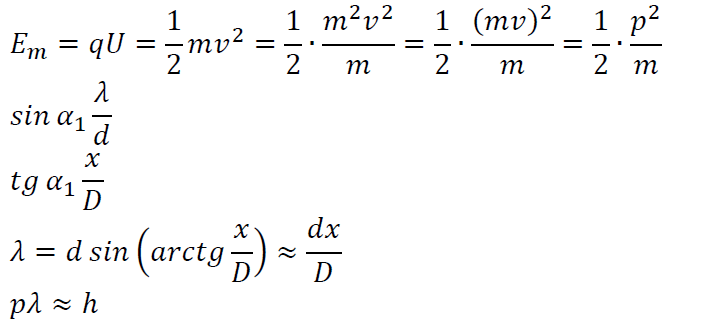
![]() Az interferenciakép adatait kihasználva meg tudták határozni az elektron hullámhosszát, amely a Planck állandó és az elektron impulzusának hányadosával megegyező értéket adott. Ez alapján az elektron is a hullám részecske kettős modellel írható le, minden elektronállapothoz hozzárendelhető egy de Broglie-féle hullámhossz.
Az interferenciakép adatait kihasználva meg tudták határozni az elektron hullámhosszát, amely a Planck állandó és az elektron impulzusának hányadosával megegyező értéket adott. Ez alapján az elektron is a hullám részecske kettős modellel írható le, minden elektronállapothoz hozzárendelhető egy de Broglie-féle hullámhossz.
![]()
6. A mikrorészecskék kvantummechanikai leírása
Az elektronhoz hozzárendelt de Broglie hullámhossz a részecske állapotát írja le. Klasszikus mechanikában a tömegpont állapotát a helyének és az impulzusának megadásával írhatjuk le. A kvantummechanikában az elektron állapotfüggvénye az az elektronhoz hozzárendelt hullám vagy hullámcsomag, amely az elektron helyéről és impulzusáról valószínűségi megállapítást tesz.
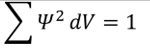
![]() Minél kisebb az elektron helyére vonatkozó bizonytalanság, annál nagyobb az impulzusára vonatkozó bizonytalanság. Minél nagyobb az elektron helyére vonatkozó bizonytalanság, annál kisebb az impulzusára vonatkozó bizonytalanság. Az elektronhoz tehát szűk bezárási tartományban többféle impulzusérték tartozhat, szélesebb bezárási tartományban kevesebb féle impulzusérték tartozhat. Ez abból is következik, hogy kis helyre bezárt elektronra több erő hathat, mint egy szabad elektronra.
Minél kisebb az elektron helyére vonatkozó bizonytalanság, annál nagyobb az impulzusára vonatkozó bizonytalanság. Minél nagyobb az elektron helyére vonatkozó bizonytalanság, annál kisebb az impulzusára vonatkozó bizonytalanság. Az elektronhoz tehát szűk bezárási tartományban többféle impulzusérték tartozhat, szélesebb bezárási tartományban kevesebb féle impulzusérték tartozhat. Ez abból is következik, hogy kis helyre bezárt elektronra több erő hathat, mint egy szabad elektronra.
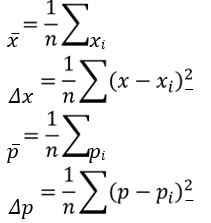
![]() A hely bizonytalansága a mért helyértékek szórásaként adódik, az impulzus bizonytalansága az impulzusértékek szórásaként adódik. A helybizonytalanság és az impulzusbizonytalanság komplementer mennyiségek
A hely bizonytalansága a mért helyértékek szórásaként adódik, az impulzus bizonytalansága az impulzusértékek szórásaként adódik. A helybizonytalanság és az impulzusbizonytalanság komplementer mennyiségek
![]()
7. Heisenberg-féle határozatlansági reláció
A Heisenberg-féle határozatlansági reláció kimondja, hogy egy részecske helyét és impulzusát egyszerre tetszőleges pontossággal nem tudjuk meghatározni. Ez alapján az elektronpálya fogalma értelmét veszíti. 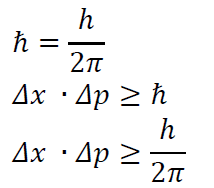
![]() Ez az összefüggés a részecske energiájára, és az adott energiatartományban való tartózkodási idejére is fennáll.
Ez az összefüggés a részecske energiájára, és az adott energiatartományban való tartózkodási idejére is fennáll. ![]()
![]()
8. Schrödinger egyenlet
Schrödinger a mikrorészecskék mozgásának leírásakor a hullámsajátosságokat vette alapul, ezért ezt az elméletet hullámmechanikának nevezzük. Később kiderült, hogy Heisenberg és Schrödinger elméletei megfeleltethetők egymásnak, mindkettő leírja a mikrorészecskék hullám részecske kettős modelljét, mindkettőből következik, hogy fizikai mennyiségeik csak kvantált értékeket vehetnek föl.
IV. Atommodellek
1. Demokritosz elgondolása az anyag felépítéséről
Először az ókori görög tudósok mondták ki, hogy az anyag atomokból áll. Az atomot oszthatatlan részecskének képzelték. Azt bizonyítani, hogy az anyag atomokból áll, csak sokkal később a Brownmozgás alapján tudták.
2. Thomson-féle atommodell
Thompson 1896-97-es kísérletében felfedezte az elektron létezését, ez alapján arra következtetett, hogy az atom egy összetett rendszer. Elképzelésére „mazsolás puding” modellként is szoktak hivatkozni. Az elgondolás szerint az atommag egy pozitív massza, amelybe elszórva találhatók elektronok. Thompson a fény keletkezését úgy értelmezte, hogy az elektronok külső hatásra elektromágneses sugárzást bocsátanak ki.
3. Rutherford-féle atommodell
3.1. Rutherford szóráskísérlete
Rutherford szóráskísérletében nagy energiájú részecskékkel bombázott aranyfüstlemez, és az részecskék ütközés következtében bekövetkezett szóródását vizsgálta egy szcintillációs cinkszulfid ernyőn, amely részecske becsapódásakor apró fényfelvillanásokat bocsát ki.
A szórási képből azt az eredményt kapta, hogy a pozitív szórócentrum 5 nagyságrenddel kisebb az atom teljes méreténél.
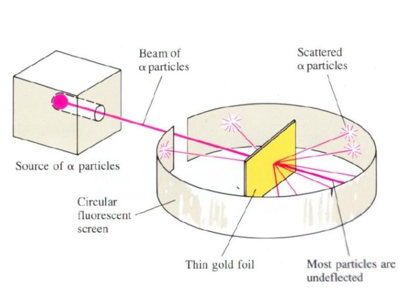
3.2. Az atommag felfedezése
Rutherford a pozitív szórócentrumot nevezte el atommagnak.
Az általa felállított atommodell szerint az elektronok az atommag körül keringenek. Ezt a modellt szokás „bolygómodellnek nevezni”. A modell szerint az elektronok pályasugara és energiája tetszőleges, a Coulomb erő tartja körpályán az elektronokat. ![]()
3.3. A modell hiányosságai
A modell szerint az elektron centripetálisan gyorsul, változik az impulzusa, így elektromágneses hullámokat bocsát ki. Ezzel energiát von el a rendszertől és így alacsonyabb pályára kerül. A klasszikus fizika szerint tehát az elektron körülbelül ~10−7 másodperc alatt belezuhan a magba.
4. A Bohr-féle atommodell
Az 1913-as Bohr féle atommodell előzménye a Rutherford-féle modell. De Bohr, hogy két kikötést tett az elektronok pályáját illetően, hogy kiküszöbölje a Rutherford-féle modell problémáit, és hogy összehangolja az atommodellt a hidrogén színképének vonalas jellegével.
Lapozz a további részletekért