Oxovegyületek
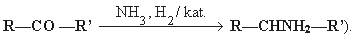
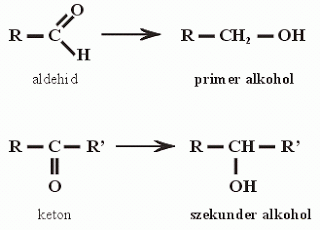
Az oxovegyületeket két csoportra oszthatjuk aszerint, hogy a kettős kötésű oxigénatom – vagyis az OXOCSOPORT – láncvégi vagy láncközi szénatomhoz kapcsolódik-e. A láncvégi szénatomhoz kapcsolódó oxocsoportot tartalmazó vegyületek az ALDEHIDEK, a láncközi vagy gyűrűs szénatomhoz kapcsolódó oxocsoportot tartalmazók pedig a KETONOK.
Az aldehidekre a formilcsoport (aldehidcsoport) illetve a karbonilcsoport, a ketonokra a karbonilcsoport a jellemző, az oxocsoport pedig mindkettőre.
ALDEHIDEK
Funkciós csoport: FORMILCSOPORT (lásd előző ábra).
Elnevezés
- A szisztematikus elnevezés (szubsztitúciós nómenklatúra szabályai szerint) az alap szénhidrogénlánc neve + -al végződés {a formilcsoportokat alkotó szénatomok beleértendők a főláncba} (metanal, etanal, propanal stb.).
- Triviális név: formaldehid, acetaldehid, fahéjaldehid, glicerinaldehid, glioxál…
- Többértékű aldehidek esetén az aldehidcsoport számát a névben jelölni kell (bután-dial).
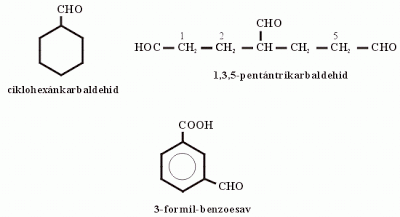
- Ciklusos aldehidek vagy nyílt láncú polialdehidek elnevezésénél a -karbaldehid utótagot használjuk. Ilyenkor a formilcsoportban szereplő szénatomokat NEM értjük bele a főláncba vagy a gyűrűs szénhidrogénbe (ciklohexán-karbaldehid; 1,3,5-pentántrikarbaldehid)!
- Ha a vegyületben másik, a felsorolásban előnyt élvező csoport van, a formilcsoportot a névben formil-előtaggal jelöljük (3-formil-benzoesav)
Homológsor: létezik. A telített, egyértékű aldehidek homológsorának összegképlete (nyílt lánc esetében):CnH2nO illetve CxH2x+1-COH
Fizikai tulajdonságok
- Hidrogénkötés kialakításában akceptor.
- A legkisebb vegyület standard halmazállapota gáz (formaldehid).
- Olvadás- és forráspontjuk azonos – nem túl nagy – szénatomszám esetén az étereknél és az észtereknél magasabb -> lévén erősebben dipólusosak, de nem éri el az alkoholok, fenolok, karbonsavakét (ezek hidrogénkötései erősebbek).
- Vízoldékonyság a kisebb molekulák esetén jó (H-kötés létesítése!), de nem korlátlan (korlátlanul oldódik vízben a formaldehid és az acetaldehid). A szénatomszám növekedel nő az apoláros láncrészlet hossza, és ezért egyre rosszabbul oldódnak vízben.
- A kis molekulájú aldehidek szúrós szagúak.
Előállítási módszerek
Primer alkoholokból:
![]()
(Ha nem desztillál át, karbonsavvá alakul.)
Karbonsav-kloriddal:
Kémiai tulajdonságok
- Jellemző rájuk a nukleofil addíció (nukleofil reagens: elektrongazdag; kötetlen e-, esetleg ? töltésű)
- Sav-bázis jelleg: vizes oldatának kémhatása semleges.
- Oxidáció: karbonsavvá történik.
- Redukció: az esetek többségében – bár nem kizárólag – a karbonilcsoporton végbemenő addíció! Katalitikus hidrogénezéssel redukálhatók (Pt-katalizátor jelenlétében), ami H addícióját eredményezi a karbonilcsoportra, és a reakció során primer alkohol keletkezik.
- Oxo-enol tautoméria (ls. előző fejezet).
- Biológiailag fontos reakció az ezüsttükör próba
Fontosabb aldehidek:
- Formaldehid (metanal)
- Acetaldehid (etanal)
- Akrolein (propénal) [Köztitermék az akrilsav propilénből kiinduló előállításánál] CH2=CH-CHO
- Citrál (izoprénvázas „terpénaldehid”)
- Retinal
- Glioxál (1,2-etándial) [Felhasználják műanyagok szintéziséhez] OHC-CHO
- Glicerinaldehid (biológiai funkció!) OHC-CHOH-CH2OH
KETONOK
Funkciós csoport: KARBONILCSOPORT
Elnevezés
- A szubsztitúciós nómenklatúra szabályai szerint a ketonokat az -on illetve -keton utótag vagy az oxo- előtag beillesztésével nevezzük el az alapszénhidrogén nevéből kiindulva. 3-CO-CH3 -> propanon v. dimetil-keton
3-CO-CH2-CH3 -> 2-butanon v. etil-metil-keton
2=CH-CH2-CO-CH3 -> 4-pentén-2-on v. allil-metil-keton
- A legegyszerűbb ketonnak, a propanonnak triviális neve is van: ACETON.
- A ciklikus ketonok elnevezésénél a ciklo- előtag alkalmazandó; illetve ha a molekulában elsőbbséget élvező csoport van (például karboxilcsoport), az oxo- előtag használandó:

Homológsor: létezik. A telített, egyértékű ketonok homológsorának összegképlete (nyílt lánc esetében): CnH2nO (n>3)
Fizikai tulajdonságok
- Hidrogénkötés kialakításában akceptor.
- A legkisebb vegyület standard halmazállapota folyadék (C3 miatt).
- Olvadás- és forráspontjuk azonos – nem túl nagy – szénatomszám esetén az étereknél és az észtereknél magasabb
 lévén erősebben dipólusosak. Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek olvadáspontja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől.
lévén erősebben dipólusosak. Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek olvadáspontja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől. - Vízoldékonyság a kisebb molekulák esetén: az aceton korlátlanul, a 4-szénatomos már erősen korlátozottan oldódik.
- A kis molekulájú vegyületek jellegzetes, édeskés szagúak.
Lapozz a további részletekért