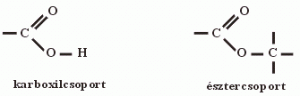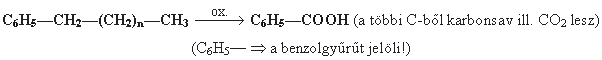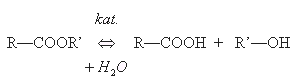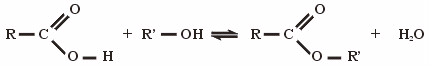Karbonsavak és észterek

Ha egy molekulán belül különböző kötésmódú oxigénatomok különböző szénatomhoz kapcsolódnak, akkor általában ugyanolyan sajátságokat hordoznak a vegyületek, mintha külön-külön volnának jelen. De ha a két különböző funkciós csoport azonos szénatomhoz kapcsolódik, olyan sajátságok lépnek fel, amelyek külön-külön egyik csoportra sem jellemzők. Ezért az ilyen molekula részleteket célszerű egyetlen egységnek, összetett funkciós csoportnak tekintenünk. Az azonos szénatomhoz kapcsolódó oxo- és hidroxilcsoportból felépülő összetett funkciós csoport a karboxilcsoport, az azonos szénatomhoz kapcsolódó oxo- és étercsoportból felépülő pedig az észtercsoport.
KARBONSAVAK
Funkciós csoport: KARBOXILCSOPORT -> -COOH
Elnevezés
- Triviális név: benzoesav, ecetsav, citromsav stb.
- Régi rendszer: az alap szénhidrogénlácból képzi a nevet, amelyhez a -sav, illetve a -disavutótagot illeszti; a szénláncba a karboxilcsoport szénatomját beleszámolja, a szénatomokat görög betűvel jelöli úgy, hogy a karboxilcsoport melletti szénatom jele a, a mellette levő b, és így tovább:
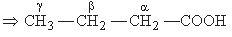
- IUPAC nómenklatúra: az alap szénhidrogénlácból képzi a nevet, amelyhez a -sav, illetve a -disav utótagot illeszti; a szénláncba a karboxilcsoport szénatomját beleszámolja, a főlánc számozását a karboxilcsoport szénatomjával kezdi!
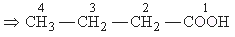
- Ha a nyíltláncú karbonsav három vagy annál több karboxilcsoportot tartalmaz, a vegyület nevét a -karbonsav utótaggal képezzük, ilyenkor a karboxilcsoportok szénatomjait NEM számoljuk bele a főláncba!
- A gyűrűs karbonsavak elnevezése is a -karbonsav utótaggal történik.
Homológsor: A telített, egyértékű karbonsavak homológsorának összegképlete (nyílt lánc esetében): CnH2nO2 v. Cx2x+1-COOH
Csoportosítás
- Karboxilcsoportok száma szerint: mono-, di-, trikarbonsav stb.
- A szénhidrogénlánc minősége szerint
- alifás karbonsavak (nyílt láncú)
- alliciklikus karbonsavak (ciklohexán-karbonsav)
- telítetlen karbonsav (R-CH=CH-COOH)
- aromás karbonsav (C6H5-COOH -> benzoesav)
Fizikai tulajdonságok
- Hidrogénkötés kialakításában donor és akceptor is lehet
- A legkisebb vegyület standard halmazállapota folyadék (HCOOH); a legkisebb dikarbonsav szilárd (HOOC-COOH)
- Olvadás- és forráspont (nem túl nagy szénatomszám esetén): magas (nagyfokú dimerizálódás! -> H-kötés). A dikarbonsavak több molekulája asszociálódik, ezeknek még a dioloknál is magasabb az olvadáspontja. (Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek olvadáspontja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől.)
- Vízoldékonyság a kisebb molekulák esetén: korlátlan (C1-C3); a dikarbonsavak rosszabbul.
- A kis molekulájú vegyületek – C1-C3 – savanyú, szúrós; C4 bűzös szagúak; a nem illékonyak szagtalanok.
Előállítási módszerek
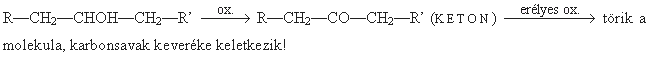
Kémiai tulajdonságok
- Sav-bázis jelleg: a vízhez viszonyítva savak. A szubsztituensek hatással vannak a savi erősségre. Ezek egy-két atomnyi távolságban hatnak, ha a szubsztituens elektronszívó (pl. halogén), a proton leadásakor keletkező aniont stabilizálja, és így növeli a savi erősséget. Így például a triklór-ecetsav az erős ásványi savak erősségével vetekszik.
- NaOH-dal, NaHCO3-tal és Na-mal is reakcióba lép.
- Oxidáció (szelektíven a funkcióscsoport szénatomját tekintve): általában csak erélyes körülmények között zajlik le.
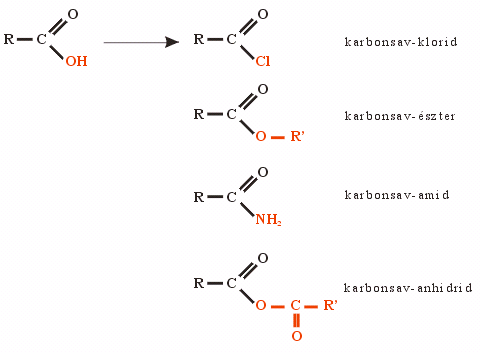
- Kémiai reakciók:
Fontosabb karbonsavak:
- hangyasav (metánsav)
- ecetsav (etánsav)
- vajsav (butánsav)
- valeriánsav (pentásav)
- palmitinsav
- sztearinsav
- olajsav
- akrilsav (propénsav)
- benzoesav
- oxálsav (etándisav)
ÉSZTEREK
Nevezéktan
Az észtereket úgy nevezzük el, mint a karbonsavak olyan származékait, amelyekben a karboxilcsoport hidrogénatomját szénhidrogéncsoport helyettesíti, vagyis amelyekben egy szénhidrogéncsoport kapcsolódik egy savmaradékhoz. Az alkánsavakból levezethető alkil-észterek típusneve tehát alkil-alkanoát.
Lapozz a további részletekért