Hőtan és Gáztörvények

2.2. A testek sűrűségének függése a hőmérséklettől
Mivel a testek sűrűsége fordítottan arányos a térfogattal, ezért térfogatnövekedés hatására csökken az anyag sűrűsége.
2.3. A víz különleges hőtágulási tulajdonságai
A víz különleges tulajdonsága, hogy sűrűsége 4°C-on a legmagasabb. Ezt a jelenséget a Bernal féle modellel lehet magyarázni. A vízjég bár 0°C-on megolvad, az anyag 5-6 molekulás csoportjai még a jég kristályrácsos szerkezetét őrzi. Ez a kristályrács bomlik fel 4°C-on, innentől kezdve a víz térfogati hőtágulási tényezője pozitív.
A víz ezen tulajdonságának fontos élettani hatása, hogy az élővizek nehezen fagynak be, ugyanis a külső hideg hőmérséklet hatására lehűlő víz a cirkuláció következtében a nagyobb sűrűségű 4°C-os víz kerül a tó aljára, a felső rétegekben a kisebb sűrűségű víz megfagy és összefüggő jégréteget képez, mivel a jég sűrűsége is kisebb a 4°C-os víz sűrűségénél. Mivel a jég jó hőszigetelő, ezért nagyobb mélységű víztérfogat nem fog teljes egészében befagyni, így a vízi állatok túlélhetik a telet.

3. Gázok hőtágulása
A gázok hőtágulása, mint térfogati hőtágulás értelmezhető. A gázok térfogati hőtágulási együtthatója megadja a gáz 0°C-on mért térfogatának egységnyi hőmérsékletváltozás esetén bekövetkező térfogat változását. Ez az állandó minden gázra megegyező pozitív érték.


3.1. Boyle-Mariotte törvénye, izotermikus állapotváltozás
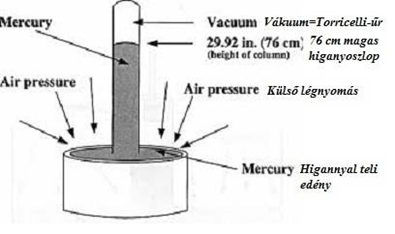
Boyle és Mariotte francia fizikusok kísérleti úton megállapították, hogy állandó hőmérséklet és anyagmennyiség mellet a nyomás és a térfogat szorzata állandó.

3.2. Gay-Lussac I. törvénye, izobár állapotváltozás
Gay-Lussac I. törvénye kimondja, hogy állandó nyomás és anyagmennyiség mellett a gáz térfogata a 0°C-on mért térfogatának -ad részével tágul ki 1°C-os hőmérsékletváltozás esetén.


3.3. Gay-Lussac II. törvénye, izochor állapotváltozás
Gay-Lussac I. törvénye kimondja, hogy állandó térfogat és anyagmennyiség mellett a gáz nyomása a 0°c-on mért nyomásának -ad részével növekszik 1°C-os hőmérsékletemelkedés hatására.


3.4. Adiabatikus állapotváltozás
Adiabatikus az a folyamat, amely során a hőfelvétel és a hőleadás 0. A rendszer termodinamikailag elzárt.
3.5. Állapotsíkok
a) Speciális folyamatok ábrázolása, átírása


b) Körfolyamatok
A körfolyamatok olyan állapotváltozás sorozatok, melyek során a gáz visszajut eredeti állapotába. Bármely állapotsíkon eléri a kiindulási pontot.

3.6. Az ideális gázok állapotegyenlete
Az univerzális gázállandó vagy egyetemes gázállandó megadja az ideális gázok egységnyi abszolúthőmérséklet és anyagmennyiség szorzatára jutó nyomás térfogat szorzatot.

∙
A Boltzmann állandó megadja az ideális gázok egységnyi abszolúthőmérséklet és molekulaszámának szorzatára jutó nyomás térfogat szorzatot.

a) Az ideális gázok állapot egyenlete


3.7. Az egyesített gáztörvény
Az egyesített gáztörvény a gáz két állapota köti kapcsolatot adja meg, az ideális gázok állapotegyenletéből vezethető le.
a) Speciális esetben az anyagmennyiség állandó

b) Izobár folyamat

c) Izochor folyamat

d) Izotermikus folyamat
3.8. Az ideális gázok kinetikus modellje
A kinetikus gázelmélet kidolgozása Ludwig Boltzmann és James Clerk Maxwell nevéhez fűződik. A kinetikus modell a részecskék mikroszkopikus tulajdonságai alapján (részecskék tömege, sebessége, impulzusa és mozgási energiája) magyarázza a gáz makroszkopikus tulajdonságait (nyomás, gáztérfogat, anyagmennyiség és abszolút hőmérséklet).
Lapozz a további részletekért