Sav-bázis reakciók és redoxireakciók – bővebben

KÉMIAI FOLYAMATOK OSZTÁLYOZÁSA 1.) A résztvevő anyagok érintkezési helye szerint
- Homogén reakció a folyamatban résztvevő anyagok egy fázisban (gáz vagy folyadék) érintkeznek egymással.
- Heterogén reakció a résztvevő anyagok csak adott felületen, a fázishatáron érintkeznek egymással.
2.) Energetikai szempontok alapján
a, exoterm
b, endoterm (ls. Termokémiai fejezet)
3.) Időbeli lejátszódás szerint
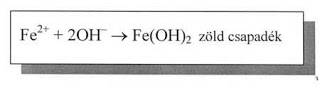
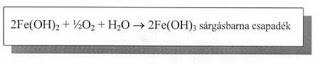
a, Pillanatszerű b, Ha a csapadékot tartalmazó kémcsövet rázogatjuk és várunk két-három percet, akkor sárgásbarna csapadékot kapunk ez tehát lassúbb folyamat. c, Nagyon lassú folyamatok (pl. a fémek korróziója). d, Végtelen lassú reakciók. A N2 (g) és az O2 (g) szobahőmérsékleten gyakorlatilag nem reagál egymással.
A reakciósebesség jellemzi a reakciók időbeli lefutását (ls. Reakciókinetika c. fejezet)
4.) A kémiai folyamatok iránya szerint
a, Egyirányú reakciók*
i) pl. csapadékképződési reakciók: Ag+ (aq) + Cl– (aq) → AgCl (s) fehér csapadék
ii) pl. gázfejlődéssel járó reakciók: 2H+ (aq) + S2– (aq) → H2S (s)
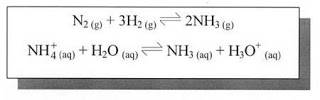
b, Megfordítható reakciók (ls. Egyensúlyok c. fejezet)*Külső kényszer hatására (pl. nagy nyomás) az egyirányú reakciók ellenkező irányba is végbemehetnek, tehát legalábbis elméletileg minden kémiai reakció megfordítható.
5.) Részecskeátmenet szempontjából
a, Protonátmenettel járó reakciók b, Elektronátmenettel járó reakciók
i) Redoxireakciók
ii) Elektrokémiai folyamatok
c, Egyéb
6.) Elsősorban szerves kémiai reakciók esetében
6.1. A reakció eredménye szerint
6.1.1. Szubsztitúció 6.1.2. Addició 6.1.3. Elimináció 6.1.4. Polimerizáció 6.1.5. Kondenzáció stb.
6.2. Elemi lépések szerint
6.2.1. Molekula- 6.2.2. Gyökös- 6.2.3. Ionos reakciók
6.3. Reagens természete szerint
6.3.1. Elektrofil 6.3.2. Nukleofil
Sav-bázis reakciók
Arrhenius szerint, a savak olyan anyagok, amelyek hidrogénionra (és anionra), a bázisok pedig hidroxidionra (és kationra) disszociálnak vizes oldatban.
Brönsted szerint, a savak proton leadásra, a bázisok proton felvételére képes anyagok. A Brönsted-féle sav-bázis fogalom magába foglalja az arrheniusi savakat és bázisokat is, de annál széleskörűbben értelmezhető:
- nemcsak vegyületek, hanem ionok is rendelkeznek sav-bázis tulajdonsággal
- nemcsak vizes oldatban értelmezhetők a sav-bázis reakciók
pl. az NH3 (g) + HCl (g) → NH4Cl (s) folyamat is annak tekinthető!
Ezen okokból a későbbiekben Brönsted elméletét alkalmazzuk a sav-bázis reakciók értelmezésekor!
Sav-bázis párok
- A sav-bázis fogalom relatív! Egy anyagot csak akkor nevezhetünk savnak vagy bázisnak, ha ismerjük a partnerét, tehát egy anyag csak valamihez képest lehet sav vagy bázis! A leszakadó proton szabadon nem létezhet, tehát egy anyag csak akkor viselkedhet savként, ha van egy másik anyag, amelyik képes megkötni a protont.
- A közhasználatban savnak illetve bázisnak nevezett vegyületek a vízhez viszonyítva savak.
- Egy reakcióban savként viselkedő anyag (pl. HCl) olyan részecskévé (Cl–) alakul, amely a mellette feltüntetett reakciópartnernek (H3O+) a protonját képes felvenni, vagyis bázis. Ez természetesen fordítva is igaz:
HCl + H2O = Cl– + H3O+ sav1 bázis2 bázis1 sav2 A hidrogén-klorid konjugált sav-bázis párja a kloridion, a vízmolekulának az oxóniumion!
AMFOTER ANYAGOK
Proton leadásra és felvételre is képesek. Az amfotéria szintén relatív fogalom. A gyakorlatban leginkább a vizes oldatokban amfoterként viselkedő anyagokról beszélünk: ilyen maga a víz, a hidrogéntartalmú összetett anionok (pl. HNO3–), illetve néhány szerves vegyület (pl. az imidazol, az aminosavak stb.). A cseppfolyós ammóniában a vízhez viszonyítva bázisként viselkedő ammónia is amfoterként viselkedik:
NH3 + NH3 = NH2– + NH4+
Erősség
Első megközelítésben azok az erős savak, amelyek könnyen adják át protonjukat, erős bázisok, amelyek könnyen protonálódnak.
A protolítikus reakciók is egyensúlyi reakciók.
Erős savaknak azokat a vegyületeket nevezhetjük, amelyek híg vizes oldatban gyakorlatilag teljesen disszociálnak, vagyis egyensúlyi állandójuk nagy. Ilyenek a szervetlen, ún. ásványi savak között akadnak: HCl, HBr, HI, H2SO4, HNO3, HClO4 stb. {pl. Ks(HNO3)= 1,2} A gyenge savak híg vizes oldatban sem disszociálnak teljesen.
Lapozz a további részletekért