Sav-bázis reakciók és redoxireakciók – bővebben

A disszociációfok (jele: α [alfa])
a hígítással még híg (c < 0,1 mol/dm3) oldatok esetén is nagymértékben nő. Gyenge savak: H2S, az oxosavak közül az alacsonyabb oxidációs számú központi atomot tartalmazó H2SO3, HNO2, HClO2, HOCl stb., valamint a szénsav (H2CO3) és a legtöbb szerves sav (HCOOH, CH3COOH, a fenol stb.).
A saverősséget a savállandóval adhatjuk meg.
Minél kisebb Ks értéke, annál gyengébb savról van szó. Erős bázisokat gyakorlatilag csak az ionvegyületek között találunk. Ilyenek az alkálifém-hidroxidok (NaOH, KOH) és a legtöbb alkáliföldfém-hidroxid {Ca(OH)2, Sr(OH)2, Ba(OH)2}, melyek vízben jól oldódnak, az oldódás során teljesen disszociálnak:
NaOH (s) = Na+ (aq) + OH– (aq)
Gyenge bázisok egyrészt azok az anyagok, amelyek molekulái közül még híg vizes oldatban sem protonálódik az összes. NH3 + H2O+ = NH4+ + OH–
Ilyen gyenge bázisok a szerves vegyületek közé tartozó aminok is. A bázisokra is igaz, hogy minél gyengébb bázisról van szó, annál kisebb a bázisállandó értéke. Továbbá gyenge bázisnak tekinthetők a vízben rosszul oldódó, rosszul disszociáló hidroxidok is. Ezek többnyire a közönséges csapadék-ként kiváló vegyületek {pl. Mg(OH)2, Fe(OH)3 stb.}, gyakorlatilag az összes p- és d-mezőbeli fém-hidroxidok. Kémhatás
A víz autoprotolíziséből H2O+ H2O = H3O+ + OH– következően a tiszta víz is tartalmaz oxónium- és hidroxidionokat. Például 25°C-on:
[H3O+]=[OH–]=1·10-7 mol/dm3
Ezek koncentrációját a bevitt savak és bázisok megváltoztatják. A bevitt sav növeli az oxóniumion-koncentrációt, ezzel – a kémiai egyensúly törvénye miatt – csökkenti a víz autoprotolíziséből származó hidroxidion-koncentrációt. A bevitt bázis növeli a hidroxidion-koncentrációt, lúgos kémhatást okoz. Csökkenti a víz autoprotolízisét, és ezzel visszaszorítja az oxóniumionok koncentrációját. A 25 °C-on fennálló összefüggés:
Kv= [H3O+]·[OH–]= 10-14
Semleges kémhatású oldatban: [H3O+]=[OH–]=1·10-7 mol/dm3,
Savas kémhatású oldatban: [H3O+] > [OH–], így [H3O+] > 1·10-7 mol/dm3,
Lúgos kémhatású oldatban: [H3O+] < [OH–], így [H3O+] < 1·10-7 mol/dm3.
A kémhatás egyszerűbb kifejezésére vezették be a pH fogalmát, amely az oldat oxóniumion-koncentrációjának negatív, tízes alapú logaritmusa:
| pH= -lg[H3O+]. |
pKv= pH+ pOH= 14 (25°C-on!)
A különböző kémhatású oldatok pH-ja:
- semleges pH = 7
- savas pH < 7
- lúgos pH > 7
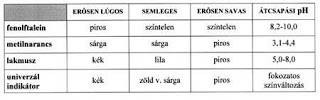
SAV-BÁZIS INDIKÁTOROK
Maguk is sav-bázis tulajdonságú anyagok, amelyek az oldat kémhatását úgy jelzik, hogy protonleadásuk vagy protonfelvételük után bekövetkező molekulán belüli kötésátrendeződésük színváltozással jár. A színváltozás meghatározott pH-tartományban történik (keverékindikátoroknál a színváltozás folyamatos)!
SÓK HIDROLÍZISE
Olyan kémiai reakció, amelyben valamilyen só anionja vagy kationja lép protolitikus reakcióba a vízmolekulákkal. Ha egy erős sav (pl.HCl) a vízzel reakcióba lép, a belőle keletkező bázis (Cl–) a mellette feltüntetett savval (H3O+) szemben igen gyenge bázisként viselkedik
| HCl | + | H2O | = | Cl– | + | H3O+ |
| erős sav1 | bázis2 | gyenge bázis1 | sav2 |
Ebből az is következik, hogy egy, a vízhez képest gyenge savból származó anion az oxónium-ionokkal szemben erős bázisként viselkedik.
| CH3COOH | + | H2O | = | CH3COO– | + | H3O+ |
| gyenge sav1 | bázis2 | erős bázis1 | sav2 |
Ha egy vizes oldatba az erős savból, illetve a gyenge savból származó ion kerül (NaCl, CH3COONa), akkor ezek közül csak a gyenge savból származó anionról feltételezhető, hogy az oxóniumionokhoz képest jóval gyengébb savként viselkedő vízmolekulákkal szemben számottevő bázicitást mutat.
A folyamat egyensúlyi állandója tulajdonképpen a gyenge savból származó anionra vonatkoztatott bázisállandó, amit hidrolízisállandónak is nevezhetünk.
Kh= Kb(CH3COO–)= = 5,6·10-10
Korábbi felfogás szerint az oxidáció az oxigénnel való egyesülés vagy a hidrogénelvonás (dehidrogénezés), a redukció az oxigén elvonás, illetve a hidrogénnel való egyesülés volt. Mai felfogásunk szerint az oxidáció elektron leadást, a redukció elektron felvételt jelent. Ez a fogalom a sav-bázis elmélethez hasonlóan magába foglalja az előző, korábban kialakított felfogás szerinti oxidációt és redukciót, de annál bővebb fogalom.
Lapozz a további részletekért