Sav-bázis reakciók és redoxireakciók – bővebben

Az oxidáció és a redukció kapcsolata
- két folyamat egymást feltételezi, mert
- egy anyag csak akkor oxidálódhat, ha a leadott elektronokat egyidejűleg egy másik anyag felveszi, így
- az oxidáló anyag a reakciópartner redukálószere, illetve a redukáló anyag a reakciópartner oxidálószere
Hirdetés
Hirdetés
Példák:
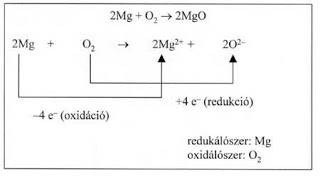
a) Két elem reakciója
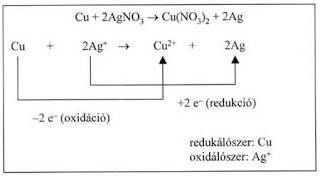
b) Fémek és fémionok reakciója
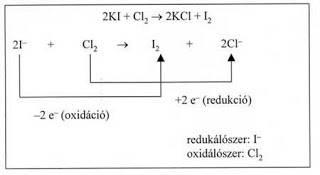
c) Nemfém és nemfémből származó ion reakciója
Az oxidáció és redukció fogalmának kiterjesztése kovalens vegyületekre
- A redoxireakciók itt részleges elektronátadással mennek végbe.
- A kötést létesítő atomok közül a nagyobb elektronegativitású közelében nagyobb az elektronsűrűség, mint elemi állapotában, tehát redukáltabb, a kisebb elektronegativitású atom ennek megfelelően az elemi állapothoz viszonyítva oxidáltabb (elektronhiányosabb).
- Az oxidáltság mértékének egyértelműbb meghatározására megalkották az oxidációs szám fogalmát (ls. később).
- Az oxidációs szám növekedése oxidációt, csökkenése redukciót jelent.
Hirdetés
Oxidációs szám
- Tényleges vagy névleges (fiktív) töltés, mely az elemi állapothoz viszonyított oxidációs állapotot mutatja meg.
- A fentiek alapján az elemek oxidációs száma mindig 0.
- Ionok (egyszerű ionok, pl. fémionok, oxidionok stb.) oxidációs száma megegyezik a töltéssel. A Na+ oxidációs száma +1, azaz ennyivel oxidáltabb az elemi állapotnál.
- Kovalens vegyületeknél a kötést létesítő elektronpár(oka)t képzeletben a nagyobb elektronegativitású atomhoz rendeljük, és az így kialakult fiktív ionok töltését tekintjük az adott atom oxidációs számának. A vízmolekulában ténylegesen csak részleges negatív töltés van az oxigén atomtörzse körül, mégis az oxidációs szám megállapításának szabályai szerint az O2-és H+ ionok töltése alapján az oxigénnek -2, a hidrogénnek +1 az oxidációs száma.
A kovalens vegyületek oxidációs számának megállapítása
- Az elemek atomjainak oxidációs száma 0.
- A hidrogén oxidációs száma a vegyületekben általában +1. Kivételt képeznek a fém-hidridek, ahol a hidrogén oxidációs száma -1.
- Az oxigén oxidációs száma vegyületekben általában -2. Kivételt képeznek a peroxidok, ahol az oxigén oxidációs száma -1, valamint a F2O
- A vegyületekben a képletben szereplő atomok oxidációs számainak összege 0 (a vegyületek ugyanis semlegesek).
- Az összetett ionokban az oxidációs számok összege az ion töltésszámával egyenlő.
A redoxiegyenletek rendezésekor a leadott és a felvett elektronok mindig megegyeznek, azaz az oxidációsszám-változások összege 0.
Lapozz a további részletekért