A periódusos rendszer
Periódusos rendszer felépítése
Az atomok szerkezete: az atomnak két fő része van:
- atommag, kétféle részecskéből épülnek fel:
- proton: tömege és pozitív töltése van, a periódusos rendszerben a rendszám megmutatja, hány darab van belőle.
- neutron: töltése nincs, tömege van, a periódusos rendszerben a protonnal együtt darabjainak száma a tömegszámot adja .
- elektron: tömegük igen kicsi és negatív töltésük van. Különböző sugarú pályákon keringenek, ezeket a pályákat héjaknak nevezzük. A héjakat az atommagtól 1 – 7-ig számozzuk, ez lesz a periódus szám, amelyet a periódus rendszer baloldali függőleges oszlopában van feltüntetve.
A kémiai reakciókban azok az elektronok vesznek részt, amelyek a külső elektronhéjon helyezkednek el. Ezek a vegyérték elektronok. Az atom többi része az atomtörzshöz tartozik – nem vesznek részt a kémiai reakciókban. Az atomtörzset az atommag és a belső, lezárt alhéjak alkotják.
Egy-egy elektronhéjon annyi elektron keringhet, ahány elfér rajta. Férőhely szempontjából az egyes elektronhéjakon szigorúan meghatározott számú elektron kering: az első héjon 2 elektron, a másodikon 8 elektron, a harmadikon 18 elektron, stb. Bármely atom elektronjainak számát a 2n2 képlettel számoljuk ki, ahol az n a héjak sorszámát jelenti.
Ezek az elektronok még egy héjon belül sem egy konkrét rádiusszal meghatározható körpályán találhatók, hanem ezek a rádiuszok a sorszámmal együtt növekvő szélességű sávok, ezeket a sávokat alhéjaknak nevezzük, és betűkkel jelöljük (s=2e–, p=6e–, d=10e–, f=14e–), az alhéjak száma négynél tovább nem emelkedik.
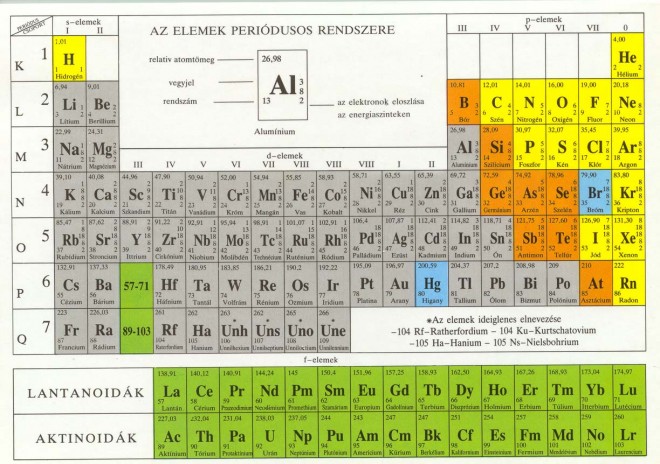
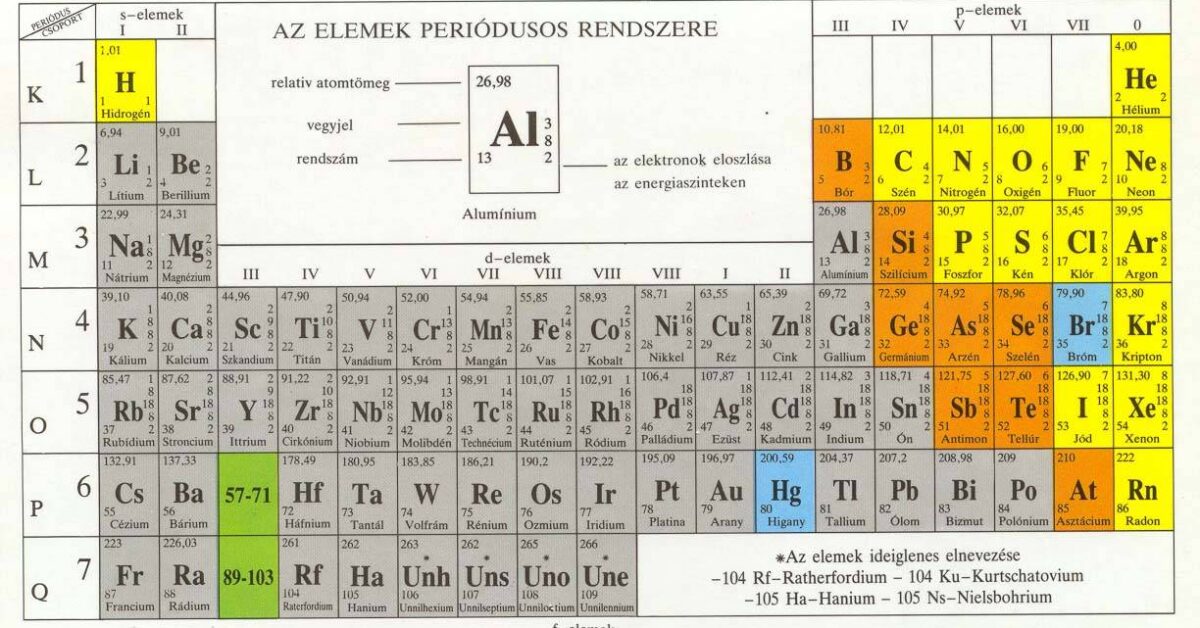
A periódusos rendszer az elemeket rendszerbe foglalja.
A periódusos rendszer logikája:
- az elemeket növekvő rendszám (ami a protonszám, ami megegyezik az elektronok számával) szerint vízszintes sorokba soroljuk;
- minden vízszintes sor egy adott elektronhéj kiépítésével kezdődik, és annak telítődésével fejeződik be, vagyis a megfelelő nemesgázzal. Egy-egy vízszintes sort periódusnak nevezzük, összesen 7 periódus van, 1 – 7-ig sorszámozva (a periódusos rendszer vízszintes sorában);
- az egymás alá kerülő elemek oszlopokat alkotnak. Az első oszlopba tartozó elemek külső elektronhéja azonos, ezeket az oszlopokat római számmal I – VIII-ig számozzuk. Minden oszlopba két csoport tartozik, az A és a B csoport.
- az oszlopokat az alhéjak kiépülése mezőkre osztja, így az alhéjaknak megfelelő mezők léteznek, s mező elemei: He IA IIA oszlopokban (s alhéj épül ki), d mező elemei: összes d oszlop (d alhéj épül ki), f mező: lantanidák (14 elem, 4 f alhéj épül ki), aktinidák (14 elem, 5 f alhéj épül ki);
- bór-polónium vonal két nagy csoportra osztja az elemeket: a vonaltól jobbra nemfémes elemek, a vonaltól balra fémes elemek találhatóak;
- a rendszerben a 6. periódustól kezdve kisebb-nagyobb szabálytalanságok vannak, de ezeket majd a fémes elemeknél fogjuk bővebben kifejteni.
Mengyelejev rendszere a kémiai elemeket rendszerezi a növekvő rendszám alapján, úgy, hogy a hasonló vegyértékhéjú elemek egymás alá kerülnek.
A vízszintes sorok a periódusok: a periódusok száma megadja az abban a periódusban lévő atomok elektron héjainak a számát. A függőleges sorok a csoportok:
- 8 főcsoport 1.A-8.A
- 8 mellékcsoport 1.B-8.B. (a 8.B csoport három oszlopot foglal el).
A főcsoportok száma megadja az abba a csoportba tartozó atomok vegyérték elektronjainak a számát. A legfontosabb csoportok nevet is kaptak:
- 1.A. alkáli fémek (kivéve a hidrogén)
- 2.A. alkáliföldfémek
- 7.A. halogének
- 8.A. nemesgázok
A nemesgázok kitüntetett szerepet töltenek be a kémiai elemek között, mivel vegyértékhéjuk telített. A s2p6 szerkezetet nevezzük nemesgáz szerkezetnek. A bór-asztácium vonal a kémiai elemeket három részre osztja:
- A vonaltól jobbra a nem fémek
- A vonaltól balra a fémek (kivéve a hidrogén)
- A vonal mellett lévő elemek az átmeneti fémek