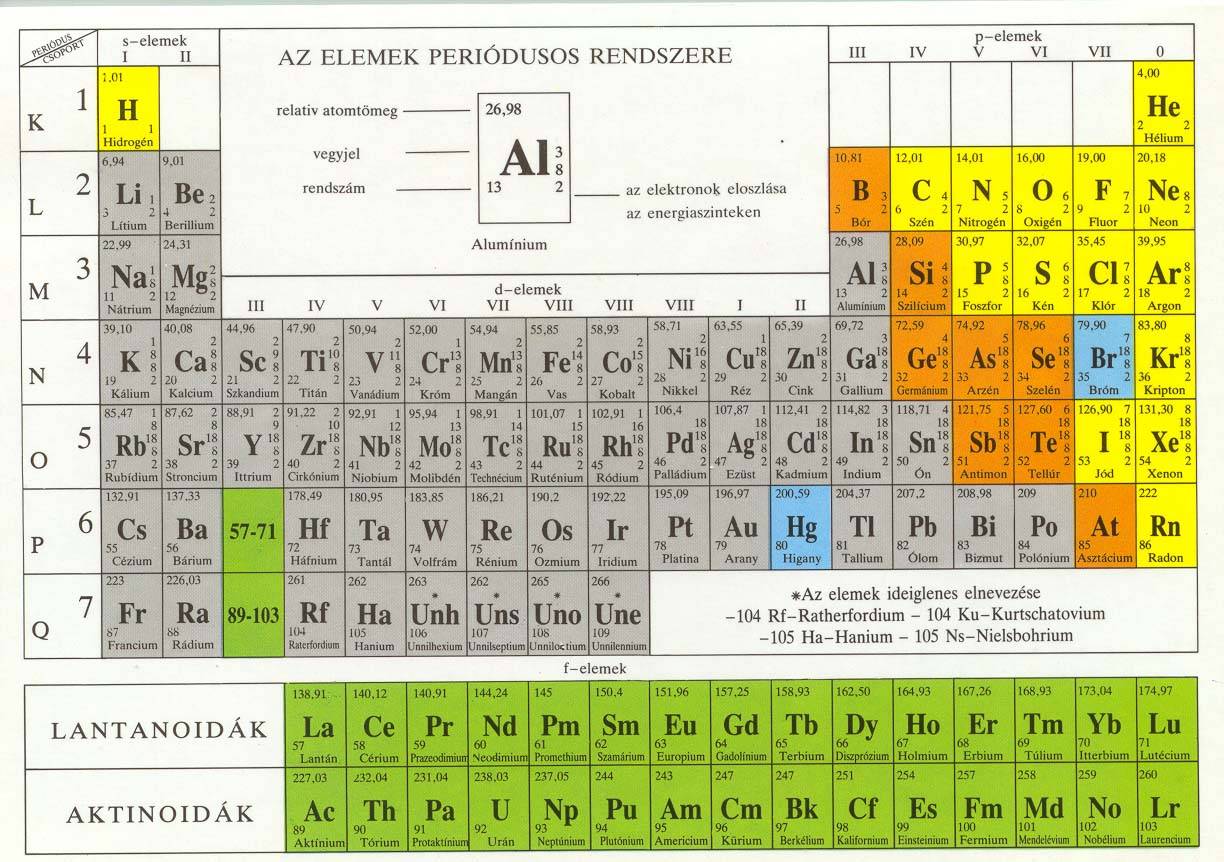
A nemfémes elemek és egymással képzett vegyületeik

2H2O = O2+4H +4e–
(anódfolyamat)
Víz (H2O) A tiszta víz színtelen, szagtalan, ízetlen folyadék. A természetben légnemű, folyadék és szilárd állapotban is előfordul. A víz dipólusmolekulából álló vegyület. A víz jellegzetes tulajdonságai: olvadás és forráspontja lényegesen magasabb, sűrűsége nagyobb, mint a hidrogén vegyületeké. Víz sűrűsége +4°C-on a legnagyobb, fagyáskor 0°C-on sűrűsége csökken, térfogata megnő. A víz a leggyakoribb poláris oldószer, oldja a savakat, bázisokat és a sókat.
Kén (S) A kén sárga színű anyag. Molekularácsos kristályát nyolcatomos (S8) molekulák alkotják, amelyekben a kénatomokat kovalens kötések kapcsolják össze. A kén olvadás pontja viszonylag alacsony, keménysége kicsi. A kén vízben oldhatatlan, apoláris oldószerekben oldódik. Szilárd halmazállapotú, mérgező anyag. Reakcióba lép fémekkel (szulfidokat képez) és nem fémekkel is. Képes kétszeres negatív ion képzésre, ez az ún. Szulfition.
Kéndioxid (SO2) A kéndioxid színtelen, szúrós szagú mérgező gáz, a savas esőkért felelős, növényekre káros, vizek kémhatását savassá teszi. Használják fertőtlenítőként. Ipari szennyezőanyagként kerül a légtérbe.
Kénsav (H2SO4) A kénsav színtelen, szúrós szagú, maró hatású folyadék. Vizes oldata erősen savas kémhatású. Oldja a negatív standard potenciálú fémeket hidrogéngáz fejlődése közben:
H2SO4+Ca = CaSO4+H2
A tömény kénsav néhány fémet passzivizál (Fe). Előállítása elemi kénből történik:
S+O2 =SO2
A nitrogéncsoport nemfémes elemei és vegyületei
Iont nem képeznek, kovalens kötésű molekulákat hoznak létre. Biológiailag rendkívül jelentős elemek, ugyanis a nitrogén építőeleme a nukleinsavaknak és fehérjéknek. A foszfor 50%-ban a nukleinsavakban illetve a csontok felépítésében van jelen. Körforgásban vannak a természetben. A növények számára rendkívül fontosak, a talaj nitrogén és foszfor tartalmát trágyázással folyamatosan pótolni kell.
Nitrogén (N2) A nitrogén kétatomos molekulát alkot, benne háromszoros kötéssel. A nitrogén a levegő 70-80%-át alkotja. Színtelen, szagtalan, alacsony forráspontú gáz, vízben alig oldódik. A nitrogén nem reakcióképes, ún. inert gáz. Megfelelő körülmények között az oxigénnel reakcióba lép:
N2+O2 = 2NO
Megfelelő körülmények között a hidrogénnel is reakcióba lép, ammónia képzése közben:
N2+3H2 = 2NH3
A levegő cseppfolyósításával állítják elő. Ammónia és salétromsav előállítására használják.
Ammónia (NH3) Az ammónia a természetben nem fordul elő. Színtelen, szúrós szagú, mérgező gáz, vízben jól oldódik, vízzel ammónium-hidroxidot képez:
NH3+H2O = NH4OH
Proton megkötésére képes, tehát bázis. Savakkal reakcióba lép só képzés közben:
NH3+HCl = NH4Cl
Előállítása szintézissel történik: elemeiből állítják elő (lásd a nitrogénnél), exoterm folyamat. Salétromsav gyártására illetve műtrágyázásra használják.
Salétromsav (HNO3) A salétromsav színtelen szúrós szagú folyadék. Fény hatására bomlik. Vizes oldata erősen savas kénhatású, ugyanis a víznek protont ad át. A tömény salétromsav oldat 68%-os. Bázisokkal sót képez. A híg salétromsav csak a negatív standard potenciájú fémeket oldja fel. A tömény salétromsav oldja a pozitív standard potenciájú fémeket is. Műtrágya, robbanószer és festékek előállítására használják.
A széncsoport nemfémes elemei és vegyületei
Az elemi szén többféle allotróp módosulatban fordul elő a természetben, például gyémánt és grafit formájában. Az elemi módosulatok kristályrácsa különböző: a gyémánté atomrács, a grafité úgynevezett réteg rácsos, amely mutatja az atomrács, a fémrács és a molekularács tulajdonságait is.
- Gyémánt: A gyémánt atomrács szerkezetű, áttetsző, nagy a fénytörő képessége, a legkeményebb természetes anyag, oldhatatlan, magas az olvadáspontja, jó szigetelő.
- Grafit: A grafit rétegrács szerkezetű, nagy mennyiségben található a természetben, szürke színű, puha, a rétegekben lévő erős kötések miatt magas olvadáspontú. Jól vezeti az elektromos áramot. Előfordul: Csehország, Németország, Oroszország.
- Ásványi szenek: Nagyobb mennyiségben a szén ásványi szenek formájában fordul elő, ez nem elemi szén, elhalt élőlényekből képződött. Legkisebb széntartalmú: tőzeg, lignit, barna és fekete kőszén.
Szén-dioxid (CO2) A szén-dioxid színtelen, szagtalan gáz. A levegőnél nagyobb sűrűségű, az égést nem táplálja, kis koncentrációban nem mérgező, nagyobb mennyiségben belélegezve a vér pH értékét csökkenti. Nagy nyomáson cseppfolyósítható, acélpalackban hozzák forgalomba. Párolgás közben erősen lehűl, úgynevezett szárazjéggé alakul. Vízben oldódik, vizes oldata a szénsav. Széntartalmú anyagok elégetésénél keletkezik. Laboratóriumi előállítása mészkő és sósav reakciójával történik. Számos ipari eljárás alapanyaga.
Lapozz a további részletekért